1-12 鉛蓄電池
基本構成は1859年プランテの発明から変わっていない!
最初の二次電池事例は、➊鉛蓄電池である。図1の電池年表にも示したように、鉛蓄電池は1859年にガストン・プランテにより発明された。プランテの発明した電池は2枚の薄い鉛板の間に2本のテープ(ゴム帯)を挟んで円筒形に巻き込み希硫酸を充填するといった構成であった¹⁾。現在では正極に二酸化鉛PbO₂、負極に海綿状の鉛Pb、電解液として希硫酸を用いた構成のものが広く用いられている。不思議に思えるかもしれないが、最新のHV、EVにも12Vの鉛蓄電池が用いられている。モーター以外は従来のクルマと同じく12V系で電気システムが成り立っているからだ。節1-10でも触れたように、鉛蓄電池の放電は負極で電子が正極に移動することになり、鉛イオンが電解液中の硫酸イオンと硫酸鉛を生成し、正極では移動してきた電子により二酸化鉛と希硫酸により硫酸鉛と水を生成する。充電では負極にやって来た電子により硫酸塩が鉛と硫酸に、正極では電子を放出して硫酸鉛と水が二酸化鉛と硫酸に戻るという電気分解をしている。では、その化学反応、酸化還元反応について説明していきたい。
まず、放電のしくみから説明していこう。鉛蓄電池の放電時におけるイメージと化学反応式を図23に示した。化学反応式の詳細が興味ある方は、後の付図を参考にして頂きたい。鉛蓄電池は前節の図21に示したように、負極は鉛Pb、正極は二酸化鉛PbO₂、電解液は希硫酸H₂SO₄、水H₂Oで構成されている。
電池内の酸化還元反応は少々複雑?ゆっくり理解していこう!
図23においてランプにスイッチが入る前は、負極板には電流としてはたらく自由電子が蓄積されている。そこで、スイッチONと同時にその自由電子が一気に流れ込む。それと同時に鉛Pbは鉛イオンPb²⁺として電解液中に溶け出していく。希硫酸は水により硫酸イオンSO₄²⁻と水素イオンH⁺に電離している。この硫酸イオンSO₄²⁻と鉛イオンPb²⁺が反応して硫酸鉛PbSO₄を生成する。この硫酸鉛PbSO₄は負極表面に固体になって付着していく。
また、重要な自由電子e⁻は導線から負荷(ランプ)を通って正極に向かう。さらに電解液中には水素イオンH⁺も放たれる。水素イオンH⁺は自由電子が集結した正極に向かって電解液中を移動する。
一方、正極板では負極からやって来た自由電子e⁻、水素イオンH⁺を受け入れ、二酸化鉛PbO₂と希硫酸H₂SO₄とで化学反応を起こし、硫酸鉛PbSO₄、水H₂Oを生成する。負極板と同じく硫酸鉛は正極板に付着していく。ただし、負極板と比較すれば、二酸化鉛はイオンになり難い金属なので、その反応はかなり小さい。また、放電が続けば、水が生成されて希硫酸はより薄まっていく。放電のしくみについて図23がイメージできれば、先ずは理解されたと思っていい。
図23 鉛蓄電池の放電
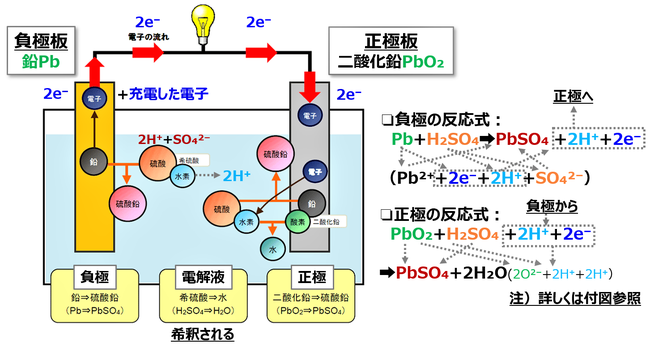
出典☛「鉛蓄電池の充放電⑴放電のしくみ」@(株)インフューズ より加筆
では次に充電のしくみについて説明しよう。先ず図24を見ながら負極板の化学現象から説明していこう。充電器から十分な自由電子が供給されていく。電子には強い電気分解の能力があり、正極から自由電子e⁻、水素イオンH⁺を受け取って、負極板に付着した硫酸塩を鉛Pb、硫酸H₂SO₄に還元していく。
一方、正極板の反応は少々ややこしい。充電器からの要求で電子を送り込む必要がある。そのため、電子からいわゆる還元反応である電気分解を要求されるわけである。さらに次の2点を頭に入れておくと分かり易い。鉛は外周に4個の電子が周回している。つまり、Pb²⁺にもPb⁴⁺にもなり得るということだ。さらには正極板近くの水を電気分解させられる。
具体的に説明していこう。正極に付着した硫酸鉛は最終的には鉛イオンPb²⁺、硫酸イオンSO₄²⁻、自由電子e⁻に、また水は水素イオンH⁺、酸素イオンO²⁻(図示)もしくはOH⁻イオンに電気分解される。そして、二酸化鉛PbO₂、硫酸H₂SO₄に還元されて、自由電子e⁻を充電器へ、水素イオンH⁺を電解液を通って正極へ移動させるというわけだ。
鉛蓄電池は結構複雑な化学反応を行って充放電を繰り返していることがわかる。ただし、この反応がこの後説明する電池と違って正負極板上で行われる化学反応であるため、充放電の電力量が十分でない。やはり、性能を上げるためには正負極金属の体積全体で化学反応を行わせる必要がある。@2021.10.15記
図24 鉛蓄電池の充電

出典☛「鉛蓄電池の充放⑵充電のしくみ」@(株)インフューズ より加筆
付図 鉛蓄電池の放電@化学反応の詳細
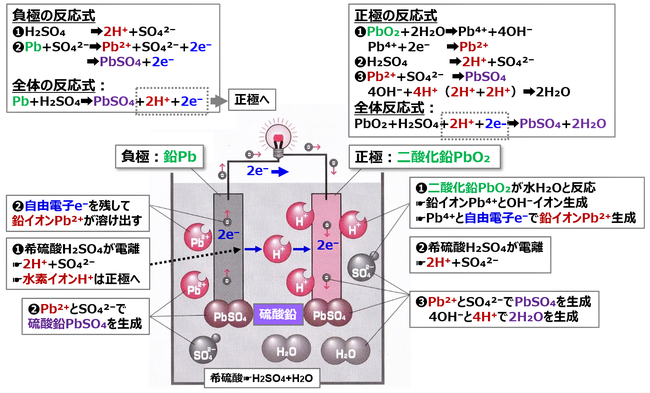
出典☛「電気の基本としくみがよくわかる本」福田務@ナツメ社;P76 より加筆