1-7 化学電池とは?
酸化還元反応=化学電池のエネルギー源?
さて、これまでの電気、電解液等の知識を基に、化学電池のはなしに移ろう。そもそも化学電池とは、専門的に表現すると「物質自身が持つ化学的なエネルギーを酸化還元反応によって電力として取り出す装置」のことをいう。
酸化とは金属と酸素が酸化物をつくることをいい、還元とは酸化物から酸素が奪われて元の金属に戻ることをいう。また、酸素を伴わない反応では電子を放出する反応を酸化といい、電子を受け取る反応を還元という。電池では双方の反応が存在している。
一般に酸化還元反応を同じ場所で行うと熱エネルギーが発生する。これはある程度自由に運動していた分子、イオンなどが分子間力やイオン結合によって束縛されたため、余分な運動エネルギーが熱となる。ところが、酸化反応と還元反応を別々の場所で行わせることで、電子、イオンが流れる経路をつくり、結果的に電気エネルギーに変えることができる¹⁾。これが化学電池の原理となる。
具体的にその原理とは、イオン化傾向²⁾の違う2種類の金属を電解液中に浸して、イオンになり易い(イオン化傾向が大きい)金属からイオンになり難い(イオン化傾向の小さい)金属へと金属イオン(プラス電荷)が移動することを利用している。この時、イオン化傾向の大きい金属つまり電子を放出する側が負極、イオン化傾向の小さい金属つまり電子を受け取る側が正極となる。電池全体では、イオン傾向の大きい金属から電子を放出(酸化)、イオン化傾向の小さい金属が電子を受け取る(還元)、という酸化還元反応が行われている:
❏負極☛電子e⁻が流れ出る側の電極(酸化反応)
❏正極☛電子e⁻が流れ込む側の電極(還元反応)
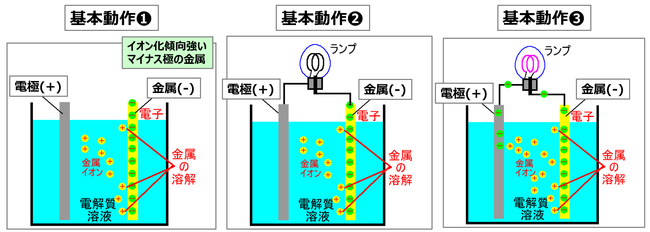
図15において具体的な基本動作を説明しよう。化学電池の基本形成は正極、負極を電解液中に入れる。そして、負荷(図の場合電球)を両極からの導線で結線、図示されていないが、両極間にイオンだけを通して電子を通さないセパレーターを設けるというのが基本である。イオン化傾向の違う2種類の金属が電解質溶液の中に入れると、イオン化傾向の大きい金属は電子を残して、陽イオンとして電解液中に放出される。この時、負極は残していった電子が過剰にある状態、つまり電位が低い状態を作り出す(基本動作➊)。
次に導線とランプを結線してみた。負極に溜まった電子は導線➡ランプ➡導線を経て正極へと移動する。そして、正極に集まった電子に引き付けられ、電解液中の金属イオン(プラスイオン)が正極に移動して、電子と結合して金属原子に戻り、陽極表面に付いて(基本動作➋➡➌;いわゆる金属メッキ)、電位が高い状態を作り出す。この2種類の金属間で起こる電位差を「電圧」もしくは「起電力」と呼んでいる。
例えば、後で節で詳しく説明するが、マンガン乾電池やアルカリ乾電池の電極は、負極が亜鉛(Zn)、正極が酸化マンガン(MnO₂)で起電力は1.5V、バッテリーなどに使われる鉛蓄電池の電極は、負極が鉛(Pb)、正極が酸化鉛(PbO₂)で起電力は2Vとなる。@2021.9.16記、2021.10.10修正
図15 化学電池の基本動作
出典☛「電池の歴史イラスト館」@InterNet 情報 より加筆
《専門用語の解説および参考文献》
1)「電池の原理は?」@高校化学と生物の要点と勉強法
2)イオン化傾向☛水溶液中の金属元素のプラスイオンになりやすさを示したもの。金属を酸などの水溶液に入れると、元素が電子を奪われ、プラスイオンになって溶けだす。下図ではLiイオンが最もイオン化傾向が強く、Auイオンが最も弱い。@受験ミカタ
